1. Introduction: Understanding Ubiquitylation
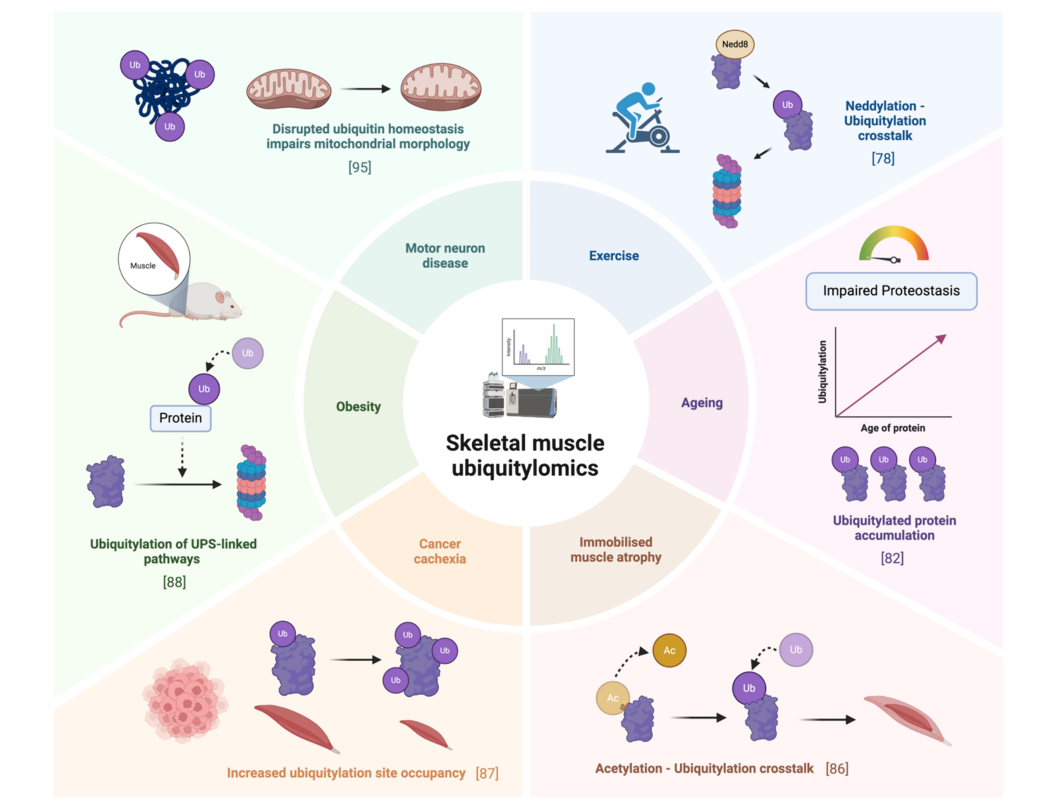
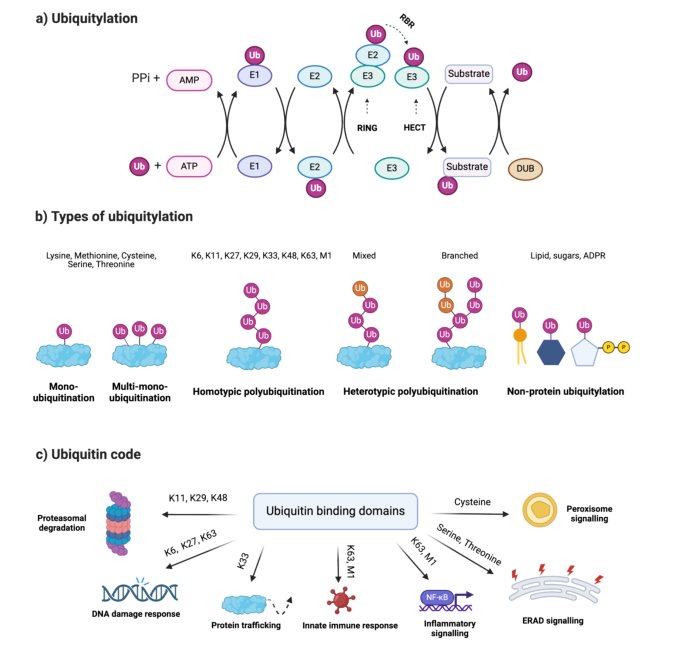
**Ubiquitylomics** is an emerging **mass spectrometry-based approach** to study **protein ubiquitylation**, a crucial **post-translational modification** that regulates **protein turnover and cellular processes** in **skeletal muscles**. This process is **essential** for muscle maintenance, yet its role in **muscle ageing, atrophy, and disease** remains **underexplored**.
2. Why Is Ubiquitylation Important?
- Regulates **muscle protein turnover** and **cell signaling**.
- Plays a **key role in muscle atrophy, ageing, and regeneration**.
- Its **dysregulation is linked to neuromuscular disorders**.
3. Ubiquitylomics: A Game Changer for Muscle Research
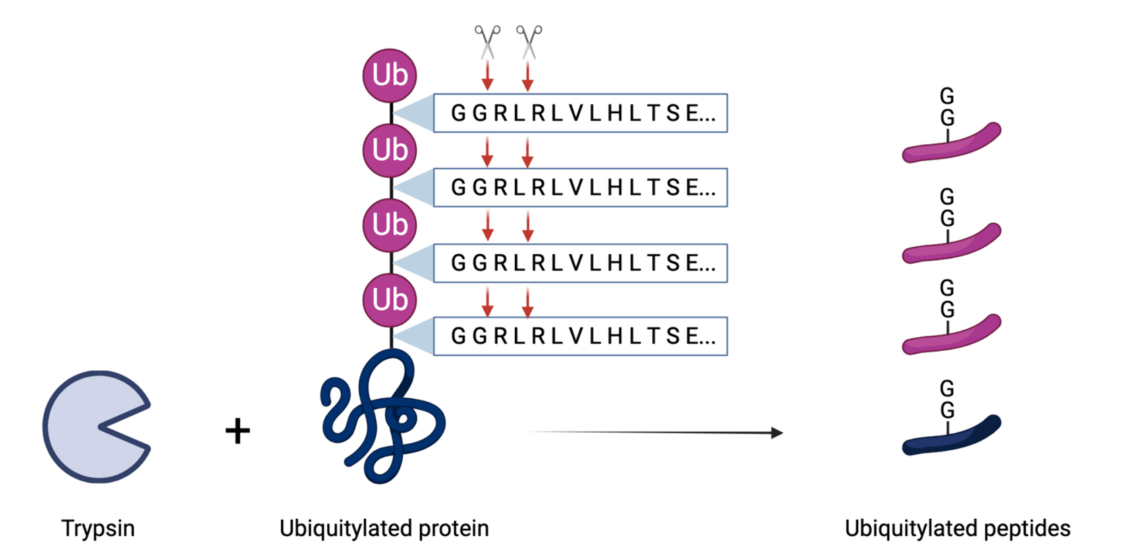
**Mass spectrometry** enables **high-throughput detection** of **ubiquitylated proteins**, providing deeper insights into **muscle proteome dynamics** during **exercise, ageing, and disease**.
4. Challenges in Ubiquitylomics Research
- **Low abundance** of ubiquitylated proteins in muscle samples.
- Technical **difficulties in preserving ubiquitylation** during sample preparation.
- Need for **advanced mass spectrometry and bioinformatics tools**.
5. Future Directions: Therapeutic and Clinical Applications
As **mass spectrometry techniques evolve**, ubiquitylomics will unlock new possibilities in **drug discovery, biomarker identification, and disease treatment**. The study of **protein crosstalk** between **ubiquitylation, phosphorylation, and acetylation** will further enhance our **understanding of muscle biology**.
6. Conclusion: A New Era in Muscle Biology
Ubiquitylomics provides a **cutting-edge approach** to studying **skeletal muscle diseases** and **protein regulation**. This field holds **tremendous promise** for developing **targeted therapies** and **understanding molecular mechanisms** behind muscle disorders.

| Published | 8/12/2024 |
| Address | https://doi.org/10.1002/jcsm.13601 |
| Authors | Samuel O. Lord1 | Harvey E. Johnston2 | Rahul S. Samant2 | Yu-Chiang Lai1,3,4 |














