1. Background and Purpose
Antisense oligonucleotide (AO)-mediated exon skipping is a promising strategy for treating genetic disorders like Duchenne Muscular Dystrophy (DMD). This method alters dystrophin pre-mRNA splicing to create a shorter but functional protein, potentially converting severe DMD into a milder Becker Muscular Dystrophy (BMD) phenotype. The paper highlights the significance of skipping exons 45–55, a common mutation area that could benefit nearly 50% of DMD patients.
2. Current Challenges
Traditional testing for exon skipping often requires muscle biopsies, which are invasive and produce cells with low proliferation rates. These limitations hinder effective drug development. The authors propose an alternative approach using fibroblasts reprogrammed into muscle cells, providing a less invasive and more reproducible cell model for testing.
3. Methods
The study outlines how DMD patient fibroblast cells are converted into muscle cells (myotubes) using the MyoD gene via a retroviral vector. These reprogrammed cells are then treated with phosphorodiamidate morpholino oligomers (PMOs) that target dystrophin exons 45–55. Techniques like flow cytometry (FACS) and immunocytochemistry validate the transformation and evaluate exon skipping efficacy.
4. Key Findings
The fibroblast-to-myotube transformation effectively models exon skipping, demonstrating that multiple exons can be successfully skipped using PMOs. This method showcases potential for developing antisense therapies that aim to restore dystrophin, making the research highly relevant for DMD treatment.
5. Significance
This innovative approach provides a scalable and less invasive method for testing antisense drugs. It addresses the challenges of muscle biopsies and offers a promising pathway for therapies that could transform the lives of many DMD patients.

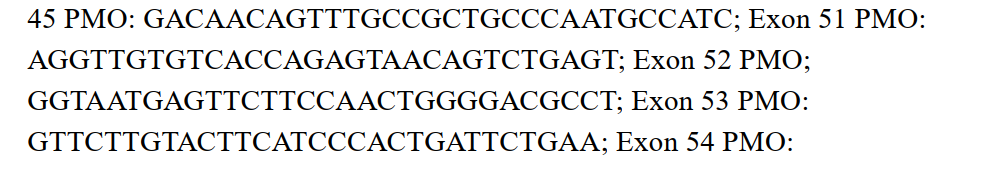
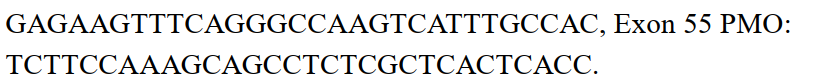
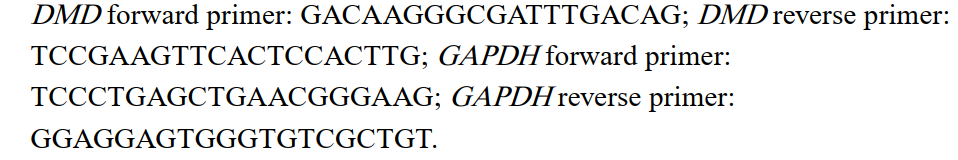



| Information | Details |
| Authors | Joshua J. A. Lee, Takashi Saito, William Duddy, Shin’ichi Takeda, Toshifumi Yokota |
| Corresponding Author | Toshifumi Yokota |
| Article Title | Direct Reprogramming of Human DMD Fibroblasts into Myotubes for In Vitro Evaluation of Antisense-Mediated Exon Skipping and Exons 45–55 Skipping Accompanied by Rescue of Dystrophin Expression |
| Publication Date | 2018 |
| Journal Name | Methods in Molecular Biology |
| Keywords | Antisense Therapy, DMD, Exon Skipping, Fibroblast, Myotube, Dystrophin |
| Methods Used | Retrovirus Preparation, MyoD Transduction, FACS, Antisense PMO Transfection, RT-PCR, Immunocytochemistry |
| DOI | 10.1007/978-1-4939-8651-4_8 |














