اختلال رونویسی اتوفاژی در مدل دیستروفی عضلانی دوشن (DMD)
خلاصه
این مطالعه به بررسی اختلال رونویسی اتوفاژی در عضلات اسکلتی موشهای mdx، مدل شناختهشده دیستروفی عضلانی دوشن (DMD)، میپردازد. تمرکز تحقیق بر روی نقش فاکتورهای رونویسی FoxO (FoxO1 و FoxO3a) و فاکتور رونویسی EB (TFEB) است که در تنظیم ژنهای مربوط به اتوفاژی نقش کلیدی دارند. یافتهها کاهش قابلتوجه بیان این ژنها را در عضلات دارای کمبود دیستروفین نشان میدهند که ناشی از سرکوب با واسطه فسفوریلاسیون FoxOs و TFEB است.
یافتههای کلیدی
1. کاهش جهانی ژنهای مرتبط با اتوفاژی
تجزیه و تحلیلهای ریزآرایه و PCR کمی، کاهش قابلتوجهی را در بیان ژنهای دخیل در تشکیل اتوفاگوزوم، همجوشی اتوفاگوزوم-لیزوزوم و میتوفاژی در عضلات تیبیالیس قدامی و کفی موشهای mdx نسبت به گروه کنترل نشان داد.
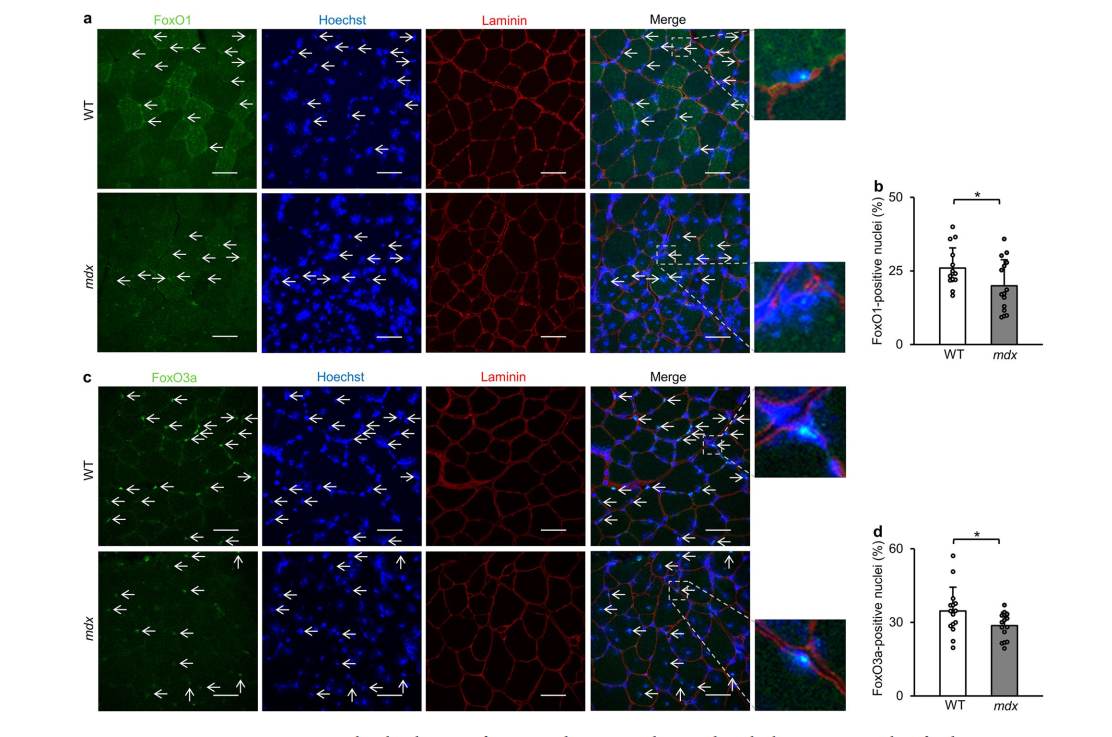
2. اختلال در تنظیم FoxO1 و FoxO3a
آنالیزهای رنگآمیزی ایمنی و وسترن بلات کاهش محلیسازی هستهای و افزایش فسفوریلاسیون FoxO1 (Thr24) و FoxO3a (Thr32) را نشان داد که بیانگر سرکوب فعالیت رونویسی ناشی از فسفوریلاسیون وابسته به Akt است.
3. اختلال در تنظیم TFEB
این مطالعه همچنین کاهش محلیسازی هستهای و افزایش فسفوریلاسیون TFEB (Ser122) را در موشهای mdx نشان داد که به سرکوب فعالیت TFEB با واسطه mTORC1 اشاره دارد.
4. تجمع نشانگرهای اتوفاژیک
افزایش سطوح پروتئینهای LC3-II و p62 مشاهده شد که نشاندهنده اختلال در تخریب اتوفاگوزوم و شار اتوفاژیک در عضلات دیستروفیک است.
5. رسوراترول به عنوان یک عامل درمانی بالقوه
نشان داده شد که درمان با رسوراترول، یک فعالکننده SIRT1، بیان ژنهای مرتبط با اتوفاژی را بازیابی کرده، فسفوریلاسیون TFEB را کاهش داده و آسیبهای عضلانی در موشهای mdx را بهبود بخشیده است.
بینش مکانیکی
- مسیر Akt-mTORC1
سیگنالدهی بیش از حد مسیر Akt-mTORC1 در عضلات دیستروفیک باعث فسفوریلاسیون و خروج هستهای FoxOs و TFEB شده و در نتیجه بیان ژنهای هدف در اتوفاژی را سرکوب میکند.
- نقش FoxOs و TFEB
هر دو فاکتور رونویسی برای حفظ فعالیت اتوفاژی ضروری هستند. سرکوب آنها منجر به تجمع پروتئینهای آسیبدیده و اندامکهای غیرعملکردی شده و در نتیجه به پاتوژنز DMD کمک میکند.
پیامدهای بالینی
این مطالعه بر اهمیت هدفگیری تنظیم رونویسی اتوفاژی برای توسعه استراتژیهای درمانی جدید برای DMD تأکید میکند. بازگرداندن فعالیت این فاکتورهای رونویسی ممکن است به کاهش انحطاط عضلانی و بهبود نتایج بالینی بیماران کمک کند.
نتیجهگیری
این تحقیق شواهدی ارائه میدهد که نشان میدهد سرکوب فسفوریلاسیون وابسته به FoxOs و TFEB در عضلات دیستروفیک نقش کلیدی در کاهش فعالیت اتوفاژی دارد. مداخلات درمانی برای بازگرداندن این مسیرها میتواند به کاهش آسیبهای عضلانی و بهبود سلامت بیماران مبتلا به DMD کمک کند.
| Published | 16/01/2024 |
| Address | DOI: 10.1038/s41598-024-51746-9 |
| Authors | Ryuta Nakashima 1, Ryusuke Hosoda 1, Yuki Tatekoshi 1, Naotoshi Iwahara 1 2, Yukika Saga 1, Atsushi Kuno 3 |














