پیشرفتهای درمانی در آتروفی عضلانی ستون فقرات و پیازی (SBMA)
آتروفی عضلانی ستون فقرات و پیازی (SBMA) یک اختلال عصبی پیشرونده با شروع در بزرگسالی است که باعث آسیب نورونهای حرکتی و ماهیچههای اسکلتی میشود.
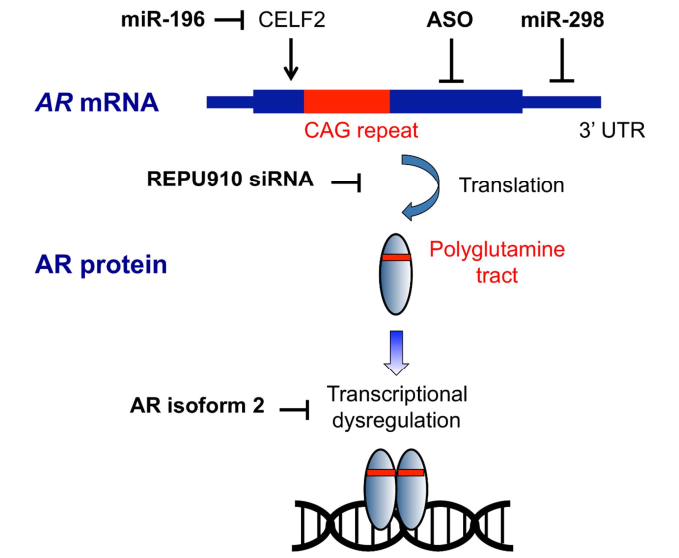
SBMA به دلیل گسترش تکرارهای سهنوکلئوتیدی (CAG) در ژن گیرنده آندروژن (AR) ایجاد میشود و دارای ویژگیهای مشترک با بیماریهای پلیگلوتامین و اختلالات نورون حرکتی است که بر سیستم عصبی مرکزی و عملکرد عضلانی تأثیر میگذارند.
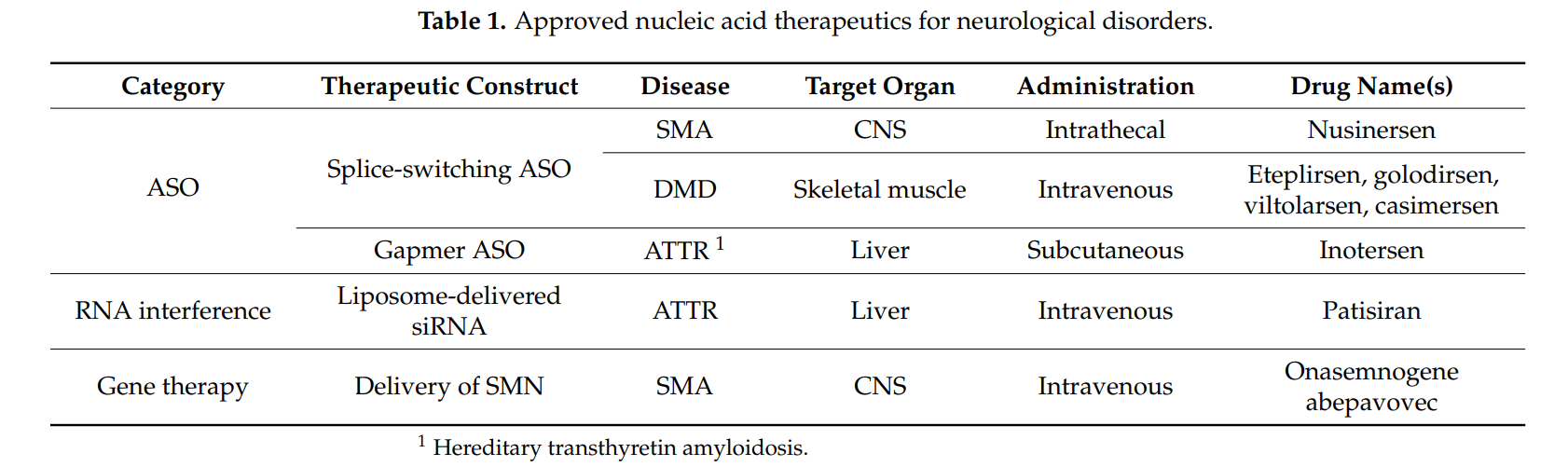
این مقاله درمانهای مبتنی بر اسید نوکلئیک، مانند الیگونوکلئوتیدهای آنتیسنس (ASOs) و RNAهای مداخلهگر کوچک (siRNAs) را به عنوان درمانهای امیدوارکننده برای SBMA بررسی میکند. این روشها با خاموش کردن ژن گیرنده آندروژن جهشیافته در مدلهای حیوانی، به بهبود بیماری کمک میکنند.
پیشرفتهای اخیر در درمانهای اسید نوکلئیک
پیشرفتهای قابلتوجهی در زمینه درمانهای ژنتیکی مبتنی بر اسید نوکلئیک حاصل شده است. از جمله:
- تداخل RNA (RNAi)
- ژندرمانی با ناقلهای ویروسی مرتبط با آدنو (AAVs)
این درمانها در حال حاضر برای سایر اختلالات عصبی، مانند بیماری هانتینگتون و اسکلروز جانبی آمیوتروفیک (ALS)، آزمایش شدهاند.
SBMA که هم نورونهای حرکتی و هم عضلات اسکلتی را تحت تأثیر قرار میدهد، چالشهای خاصی را ایجاد میکند، اما اهداف درمانی متعددی را نیز فراهم میآورد.
این مقاله پتانسیل این درمانها را برای توقف پیشرفت بیماری، با تمرکز بر محافظت از عضلات و نورونهای حرکتی، مورد بحث قرار میدهد.
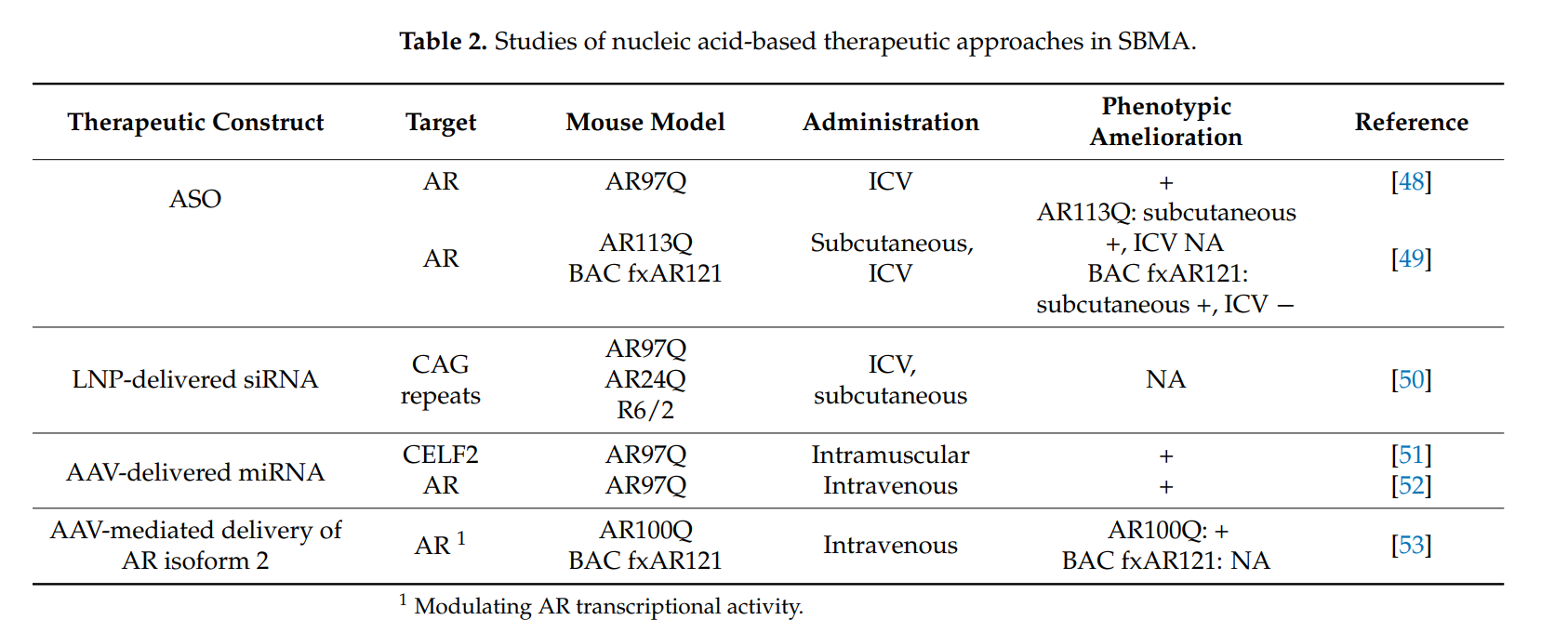
نقش ASOs و siRNAs در درمان SBMA
مطالعات اخیر نشان میدهد که ASOها میتوانند بیان گیرنده آندروژن جهشیافته را در بافت عضلانی کاهش دهند که منجر به بهبود قدرت عضلانی و افزایش بقا در مدلهای حیوانی میشود.
با این حال، انتقال دارو به سیستم عصبی مرکزی (CNS) همچنان یک چالش باقی مانده است.
در این میان، تحویل siRNA مبتنی بر نانوذرات لیپیدی بهعنوان یک استراتژی نوین برای هدفگیری تکرارهای CAG در بیماریهای پلیگلوتامین بررسی شده است.
این روش پتانسیل بالایی دارد، اما به تحقیقات بیشتری برای بهبود توزیع زیستی و افزایش کارایی نیاز دارد.
چالشهای موجود و مسیرهای آینده
این مقاله نتیجه میگیرد که در حالی که درمانهای مبتنی بر اسید نوکلئیک برای SBMA نویدبخش هستند، چالشهایی مانند توزیع دارو و حفظ اثر درمانی در بافتها باید برطرف شوند.
از جمله چالشهای کلیدی:
- توزیع محدود دارو به سیستم عصبی مرکزی (CNS)
- حفظ اثر درمانی پایدار در طولانیمدت
- کند بودن روند پیشرفت SBMA که اندازهگیری اثربخشی درمان را در کارآزماییهای بالینی دشوار میکند
برای غلبه بر این چالشها، بیومارکرهای جدید و تکنیکهای تصویربرداری پیشرفته برای ارزیابی اثربخشی درمانها مورد نیاز است.
علاوه بر این، پیشرفتهای اخیر در توسعه الیگونوکلئوتیدهای طولانیاثر و تکنیکهای ویرایش ژن، مانند CRISPR، میتوانند به توسعه درمانهای مؤثرتر برای SBMA در آینده کمک کنند.

| Published | 1/5/2022 |
| Address | https://doi.org/10.3390/ genes13010109 |
| Authors | Tomoki Hirunagi 1, Kentaro Sahashi 1, Katherine G. Meilleur 2 and Masahisa Katsuno 1,3,* |