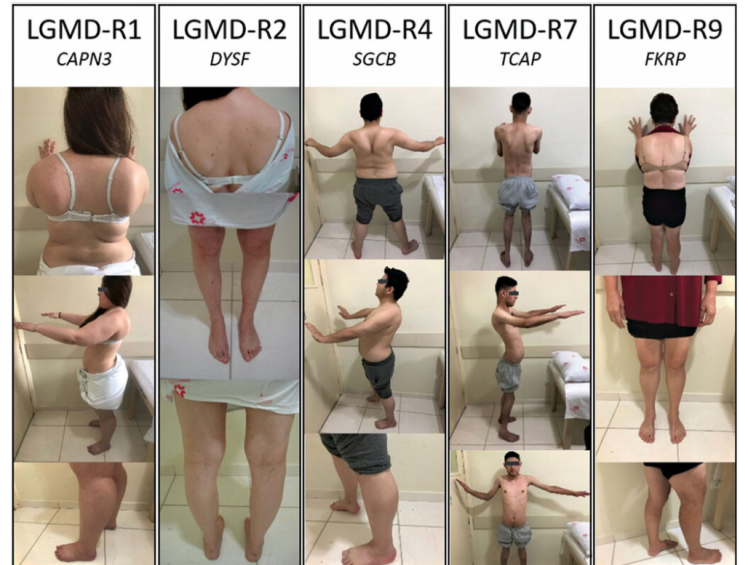
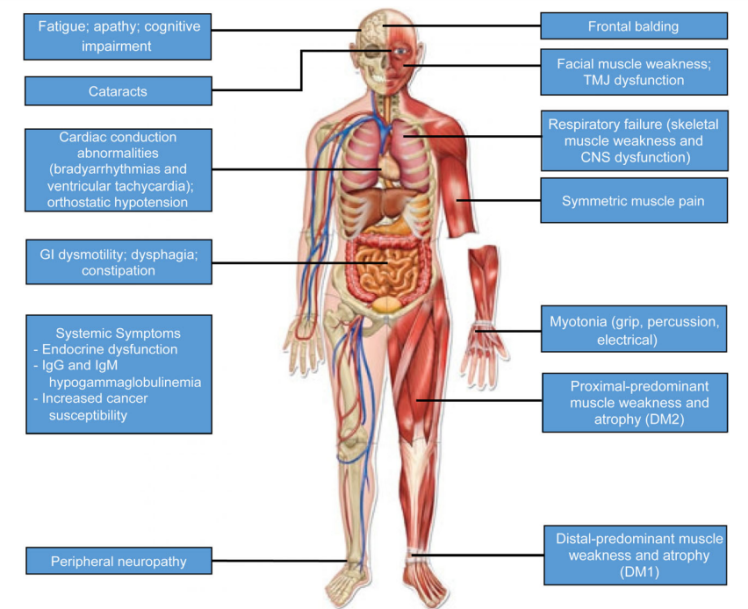
more
بینشهایی از «فرار اندوزومی و محلیسازی هستهای: موانع حیاتی برای درمان ضد حس»

الیگونوکلئوتیدهای آنتیسنس (ASOs) به دلیل محدودیت در تحویل به هسته و فرار اندوزومی، اثربخشی پایینی دارند. این مقاله راهکارهایی مانند استفاده از مواد حساس به pH، نانوذرات لیپیدی، و پپتیدهای انتقالی را بررسی میکند که میتوانند جذب و کارایی ASO را افزایش دهند. ترکیب این تکنیکها میتواند درمانهای ژنتیکی مبتنی بر ASO را بهبود بخشد.